Les abeilles domestiques (Apis mellifera) vivent en colonies composées de trois types d’individus : la reine, les ouvrières et les faux-bourdons qui, s’ils présentent des phénotypes tout à fait distincts, partagent pourtant le même génome. Comment celui-ci peut-il être à l’origine de trois phénotypes différents ? La réponse n’est pas dans le génome mais ailleurs : dans l’épigénome… Nous verrons dans cet article comment l’épigénomique et la génomique ont permis d’éclairer quelques étapes clés de la séparation des destinées.
Il est établi depuis longtemps que des variations du génotype (mutations ponctuelles, duplications de gènes, etc.) peuvent induire des modifications de l’expression des gènes et ainsi du phénotype. Plus récemment, il a été montré que le phénotype est également déterminé par des phénomènes épigénétiques. Il s’agit de changements transcriptionnels transmissibles lors de la division cellulaire, mais qui ne découlent pas de modifications dans la séquence d’ADN. La plupart des processus épigénétiques reposent sur des modifications de la chromatine, que ce soit au niveau de l’ADN ou des histones. De telles modifications peuvent être initiées par l’environnement. C’est par exemple le cas pour la vernalisation des plantes où la floraison est induite par le froid.
Des phénomènes épigénétiques sont également impliqués dans la formation des trois types d’individus retrouvés chez l’abeille domestique (Apis mellifera) : les reines, les ouvrières et les faux-bourdons. Ces derniers correspondent aux mâles et sont haploïdes alors que reines et ouvrières sont diploïdes. Ces deux phénotypes sont donc déterminés par le même génotype. Nous verrons dans cet article les mécanismes qui déterminent la différenciation en reine ou en ouvrière.
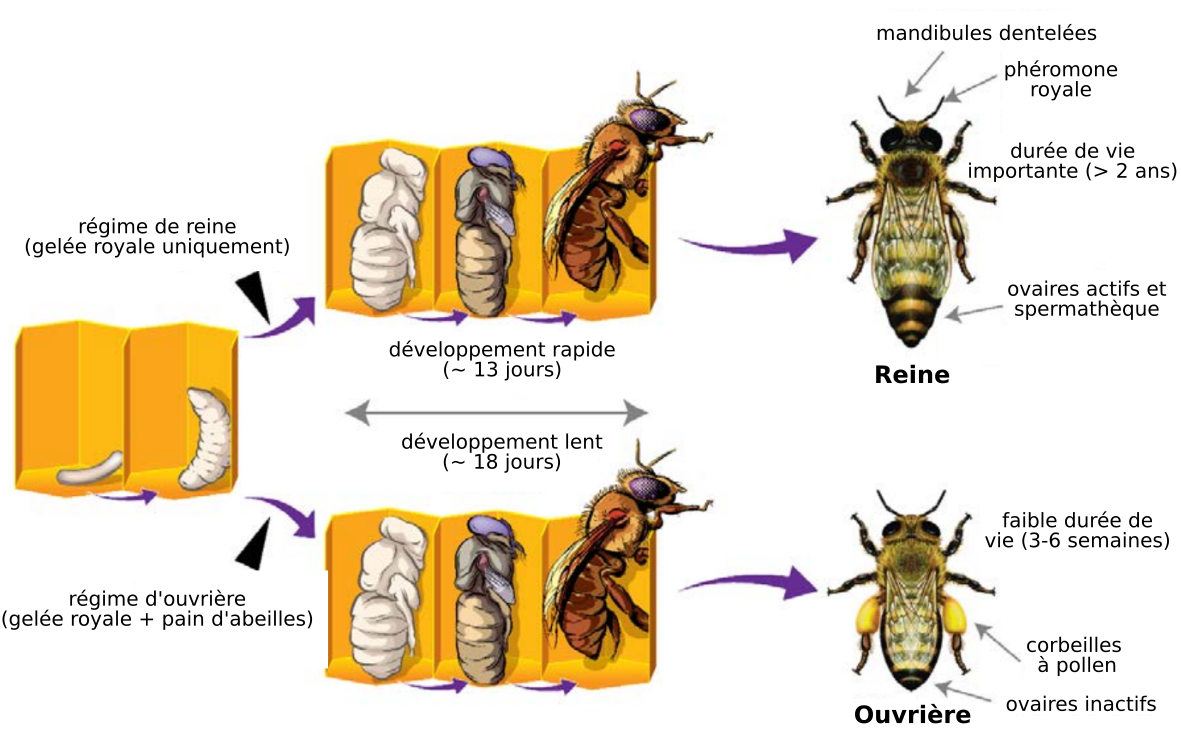
La reine se distingue des ouvrières par sa plus grande taille, notamment au niveau de l’abdomen. Elle a des ovaires développés, caractéristique à relier avec son rôle dans la ponte. Les ouvrières sont stériles, tout du moins tant qu’il y a une reine dans la ruche, sans quoi elles peuvent pondre des œufs haploïdes qui deviendront des mâles. Elles jouent différents rôles au long de leur vie comme entretenir la ruche, nourrir les larves, fabriquer des rayons, ranger et récolter du pollen, etc.
La reine, au centre de l’image, est entourée par de nombreuses ouvrières.
Les larves suivent un développement embryonnaire identique avant de se différencier. Les deux phénotypes étudiés, celui d’ouvrière stérile à courte durée de vie et celui de reine fertile à longue durée de vie, présentent de multiples différences au niveau morphologique, des organes sensoriels, des membres (avec notamment la présence chez les ouvrières de corbeilles au niveau des pattes arrières, qui permettent de stocker le pollen), des ovaires, de la taille, etc. On sait aussi que 20 % des gènes sont différentiellement exprimés dans le cerveau de la reine et de l’ouvrière [1, 2].
Les œufs sont déposés au fond d’une cellule et éclosent en 3-4 jours. Les larves deviennent après quelques jours des pupes, puis l’abeille adulte sort de la cellule. Cette sortie s’effectue au 21e jour pour les ouvrières mais est accélérée chez les reines qui sortent vers le 16e jour.
Les processus physiologiques à l’origine de la différenciation des phénotypes sont par exemple des variations métaboliques (accélération ou ralentissement), développementales (vitesse, taille, forme). Les chercheurs se sont attelés à comprendre ces variations et les mécanismes qui les causent.
La nourriture des larves est à l’origine de la différenciation entre reine et ouvrières au stade post-embryonnaire. Les larves reçoivent toutes de la gelée royale au début du développement larvaire. Cependant, à partir du troisième jour, certaines larves sont nourries exclusivement à la gelée royale et donneront des reines. Les larves nourries avec un mélange de gelée royale et de pain d'abeilles deviendront quant à elles des ouvrières.
Comment l’épigénome est-il modifié entre ces deux phénotypes et pourquoi cela cause-t-il une modification des caractères physiques de l’abeille ?
Modifications post-traductionnelles des histones
La régulation de l’expression génétique peut passer par l’ajout ou la suppression de groupement moléculaires au niveau des histones. Une de ces modifications est l’acétylation (CO-CH3) sur les résidus lysine des histones. Ce transfert s’effectue grâce à des enzymes, les histones acétyltransférases (HAT). Cette modification permet de décompacter la chromatine, ce qui augmente l’accès des enzymes de la transcription à l’ADN. Parallèlement aux HAT, il existe des enzymes nommées histones désacétylases (HDAC) qui ont pour rôle d’enlever les groupes acétyles des histones, ce qui condense la chromatine et diminue donc l’accès à l’ADN et la transcription des gènes concernés.
Or, des acides gras jouant le rôle d’inhibiteurs d’histones désacétylases (HDACi) sont présents dans la gelée royale produite par les ouvrières et qui sert à nourrir les larves d’abeilles. Si, initialement, toutes les larves en reçoivent, après trois jours de développement seules les larves de futures reines sont nourries exclusivement de gelée royale. Chez ces dernières, la suppression des groupes acétyles des histones facilite la transcription, permettant une expression des gènes plus importantes que chez les ouvrières.
En octobre 2018, la première carte de la structure de la chromatine dans le génome entier de l’abeille a été publiée [3]. Les séquençages ont été réalisés sur des larves à 96 heures de croissance. Grâce à des techniques de ChIP-sequencing (voir encadré), les chercheurs ont identifié l’acétylation de la lysine 27 des histones 3 (H3K27ac), la triméthylation de la lysine 27 (H3K27me3) et de la lysine 36 (H3K36me3) des histones 3 comme étant des éléments clés dans la régulation de l’expression des gènes.
Ce travail a permis de mettre en évidence 2027 régions génomiques uniques significativement enrichies en H3K27ac chez la larve de reine de 96 heures, et 489 pour la larve d’ouvrière de 96 heures.
Chez la reine, les H3K27ac sont localisées principalement dans les exons de ces régions génomiques et sont proches des sites d’initiation de la transcription. À l’inverse, chez les ouvrières les H3K27ac sont localisées dans les introns. Ces H3K27ac ne sont pas directement impliquées dans la modification du niveau de transcription des gènes acétylés mais agissent comme éléments cis-régulateurs pour des gènes situés à proximité. Ainsi, ces modifications auront un rôle dans la régulation d’autres gènes importants dans la distinction reine/ouvrière.
Les signatures H3K36me3 et H3K27me3 spécifiques à une caste sont corrélées avec une expression elle aussi spécifique de gènes tels que ceux impliqués dans la neurogenèse.
Le Chip-sequencing
La technique appelée ChIP-sequencing combine les techniques d’immunoprécipitation de la chromatine (ChIP) et de séquençage haut débit. Le principe est d’utiliser des anticorps capables de se fixer à des histones possédant des marques particulières (acétylation, méthylation…). Les fragments d’ADN auxquels sont liés ces histones sont ensuite séquencés. On peut ainsi savoir quelles séquences d’ADN sont présentes au niveau de zones avec des histones possédant des marques telles qu’un groupe acétyle.
Modifications de la structure de l’ADN
D’autres molécules telles que des DNMT3 sont trouvées dans la gelée royale. Il s’agit de méthyltransférases de novo de type 3 qui transfèrent des groupes méthyles sur les cytosines de l’ADN (au niveau de promoteurs de gènes notamment). Ces méthylations modifient l’expression de gènes différemment selon leur localisation mais le mécanisme précis n’est pas connu.
Des chercheurs ont étudié le méthylome (la répartition des groupes méthyles dans le génome) du cerveau de l’abeille Apis mellifera [1, 2]. Environ 550 gènes présentent des différences significatives de méthylation entre la reine et l’ouvrière ce qui peut contribuer à leurs différences phénotypiques. La majorité des méthylations sont rapportées dans des gènes impliqués dans le développement embryonnaire et le fonctionnement du système nerveux, ils ont un rôle critique dans ces fonctions cellulaires.
La plupart des méthylations ont lieu sur les cytosines d’îlots CpG situés dans des exons, et tout particulièrement au niveau de zones d’épissage de gènes conservés dans le genre Apis. Bien que les mécanismes exacts ne soient pas connus, il apparaît que la méthylation des cytosines des CpG dans les exons soit à l’origine de variants d’épissage. Il existe donc différents variants d’un même gène en fonction de l’état de méthylation, mais le niveau de transcription en lui-même n’est pas affecté comme c’est le cas lors de la méthylation du promoteur d’un gène.
Par exemple, la méthylation d’exons de gènes codant des histones induit l’expression de différents variants d’histones, qui jouent des rôles distincts dans les processus de réparation cellulaire, division, etc. Chez les abeilles, les méthylations des cytosines, et l’expression des variants d’histones qu’elles induiraient, concourraient à modifier l’état de condensation de la chromatine et donc l’accessibilité de l’ADN aux machineries cellulaires, expliquant ainsi la mise en place de différents phénotypes.
Ces processus épigénétiques vont induire non seulement une expression différentielle des gènes entre l’ouvrière et la reine mais aussi une diversité de variants induisant différents transcrits. Ces mécanismes épigénétiques expliquent que des phénotypes aussi différents puissent être mis en place à partir d’un même génome.
Étude des produits de transcription
Des microARN dans les extraits de plantes
Le pain d’abeille est un aliment composé de pollen et de nectar fermentés et qui sert à nourrir les futures ouvrières à partir du troisième jour du stade larvaire. Sa composition a été étudiée par une équipe sino-américaine qui a découvert qu’il y a beaucoup plus de microARN (miARN) dans le pain d’abeille que dans la gelée royale [4]. Les miARN sont de petits brins d’ARN non-codant qui régulent l’expression des gènes au stade post-transcriptionnel. En effet, ils se fixent par complémentarité des bases aux ARN messagers, empêchant ainsi leur traduction. Les résultats obtenus par Zhu et ses collègues montrent que le blocage du développement de la reine, conduisant au phénotype d’ouvrière, est en partie dû au miR162a. Ce miARN cible l’ARNm codant AmTOR, une protéine de la voie TOR, favorisant entre autre la croissance et la division cellulaires. Ainsi, un transfert horizontal d’acides nucléiques, du pollen des plantes vers les larves d’abeilles, peut induire chez ces dernières un changement d’expression de gènes et une variation importante du phénotype !
Les chercheurs ont fait ingérer les miARN du pain d’abeilles, et notamment le miR162a, à des drosophiles ne fonctionnant pas avec un système de caste. Ils ont observé que celles-ci ont développé des caractéristiques physiques similaires à celles des ouvrières en présence de ces miARN : taille plus petite et nombre réduit d’ovarioles.
Des microARN produits par l’abeille
En plus des miARN apportés par l’alimentation, des miARN endogènes régulent également l’expression des gènes chez les abeilles [5].
Ashby et ses collaborateurs ont étudié l’expression différentielle des miARN endogènes chez les larves et les ouvrières afin de déterminer leurs effets sur les profils d’expression des ARNm. Les résultats montrent des corrélations (négatives et positives) entre l’expression de certains miARN et ARNm. Les chercheurs se sont également intéressés aux protéines et aux voies métaboliques concernées par ces modifications d’expression d’ARNm.
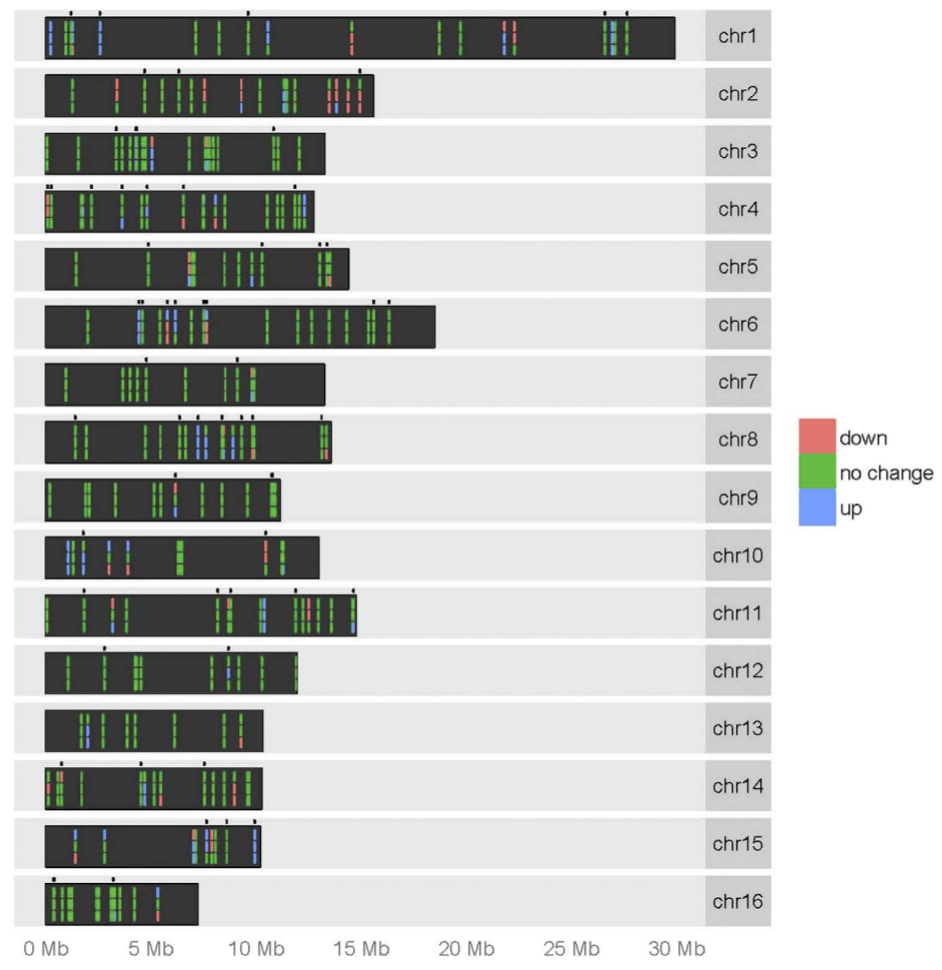
Pour chaque chromosome, la ligne supérieure représente les niveaux d’expression des miARN chez les reines par rapport aux ouvrières, la ligne médiane représente les mâles par rapport aux ouvrières et la dernière ligne représente les mâles par rapport aux reines. La couleur verte indique qu’il n’y a pas de différence statistiquement significative dans l’expression des miARN entre les deux castes comparées, le rouge représente une régulation négative et le bleu représente une régulation positive. Les points situés au-dessus de chaque chromosome indiquent l'emplacement des nouveaux miARN décrits pour la première fois dans cette étude.
Il existe de nombreuses différences dans l’expression des miARN entre reines et ouvrières. Aux 4e et 5e jours de développement (stade larvaire), les profils d'expression de certains miARN et ARN messagers diffèrent significativement entre les ouvrières et les reines. Les ARNm qui sont plus exprimés chez les reines que chez les ouvrières sont ceux qui codent des protéines impliquées dans le métabolisme protéique et les voies énergétiques. Par rapport aux reines, les ouvrières présentent un nombre plus important de transcrits codant des protéines impliquées dans la digestion, dans les voies de signalisation du développement embryonnaire (MAPK/ERK, etc.), de l’orientation cellulaire (chimiokines, etc.) et dans le développement synaptique (glutamatergique, dopaminergique, etc.). Ceci pourrait expliquer les capacités remarquables de navigation et d’orientation dans l'espace des ouvrières, comme cela a pu être supposé par d’autres travaux bien que les mécanismes ne soient pas encore clairement connus.
Les chercheurs observent que les miARN endogènes et la méthylation de l'ADN participent à la régulation de gènes différents. La méthylation de l’ADN s’effectue surtout au niveau des gènes des voies physiométaboliques tandis que les miARN ciblent principalement les transcrits (et donc l'expression des gènes) de la maturation neuronale et des différences structurelles de l’abeille.
Au final, ce sont donc plusieurs processus épigénétiques qui interviennent dans la différenciation des phénotypes, comme l’acétylation des histones, la méthylation de l'ADN les miARN endogènes et exogènes.
Modifications du contexte social
En plus de la nourriture, le contexte social des abeilles peut avoir une influence sur leur phénotype [6]. Ainsi, l’état de santé de la reine ou le nombre d’abeilles de la ruche peuvent conduire à des modifications de l’expression génétique. Par exemple des phéromones produites par la reine peuvent réduire le niveau d’expression des DNMT. Consécutivement, certains autres gènes vont ainsi subir des modifications d’expression induisant un changement de comportement des ouvrières (construction de rayon royal, augmentation des récoltes, etc.).
Les mécanismes épigénétiques, en plus d’agir au moment du développement larvaire, peut donc provoquer chez les adultes la variation d’un comportement en fonction du contexte social.
Conclusion
La mise au point et le perfectionnement des techniques d’analyse du génome, de l’épigénome et du transcriptome ont permis de caractériser les mécanismes à l’origine de la différenciation des larves en reines ou en ouvrières. Les résultats obtenus montrent que la mise en place de ces phénotypes n’a pas une origine génétique mais épigénétique. Des modifications de la condensation de la chromatine, causées par exemple par des modifications post-traductionnelles des histones, induisent une variation de l’expression des gènes, permettant une transformation phénotypique. De plus, la régulation de l’expression peut aussi s’effectuer à l’état post-transcriptionnel via des miARN présents dans l’alimentation des larves, mais aussi par ceux produits par les abeilles elles-mêmes et dont l’expression est également contrôlée par des processus épigénétiques. Il n’y a pas un unique événement qui induit une transformation de la larve en future ouvrière mais plusieurs éléments épigénétiques interviennent.
Ces événements sont en lien étroit avec l’alimentation mais d’autres signaux environnementaux peuvent modifier l’épigénome. La question des effets de la pollution environnementale sur l’expression génétique, non seulement chez l’abeille ou l’Homme, mais sur tout le vivant, mérite d’être posée.
Références
- F. Lyko, S. Foret, R. Kucharski, S. Wolf, C. Falckenhayn, et R. Maleszka, « The Honey Bee Epigenomes: Differential Methylation of Brain DNA in Queens and Workers », PLOS Biol., vol. 8, no 11, p. e1000506, nov. 2010.
- S. Foret et al., « DNA methylation dynamics, metabolic fluxes, gene splicing, and alternative phenotypes in honey bees », Proc. Natl. Acad. Sci. U. S. A., vol. 109, no 13, p. 4968‑4973, mars 2012.
- M. Wojciechowski, R. Lowe, J. Maleszka, D. Conn, R. Maleszka, et P. J. Hurd, « Phenotypically distinct female castes in honey bees are defined by alternative chromatin states during larval development », Genome Res., vol. 28, no 10, p. 1532‑1542, oct. 2018.
- K. Zhu et al., « Plant microRNAs in larval food regulate honeybee caste development », PLoS Genet., vol. 13, n o 8, août 2017.
- R. Ashby, S. Forêt, I. Searle, et R. Maleszka, « MicroRNAs in Honey Bee Caste Determination », Sci. Rep., vol. 6, janv. 2016.
- L. Holman, K. Trontti, et H. Helanterä, « Queen pheromones modulate DNA methyltransferase activity in bee and ant workers », Biol. Lett., vol. 12, no 1, janv. 2016.